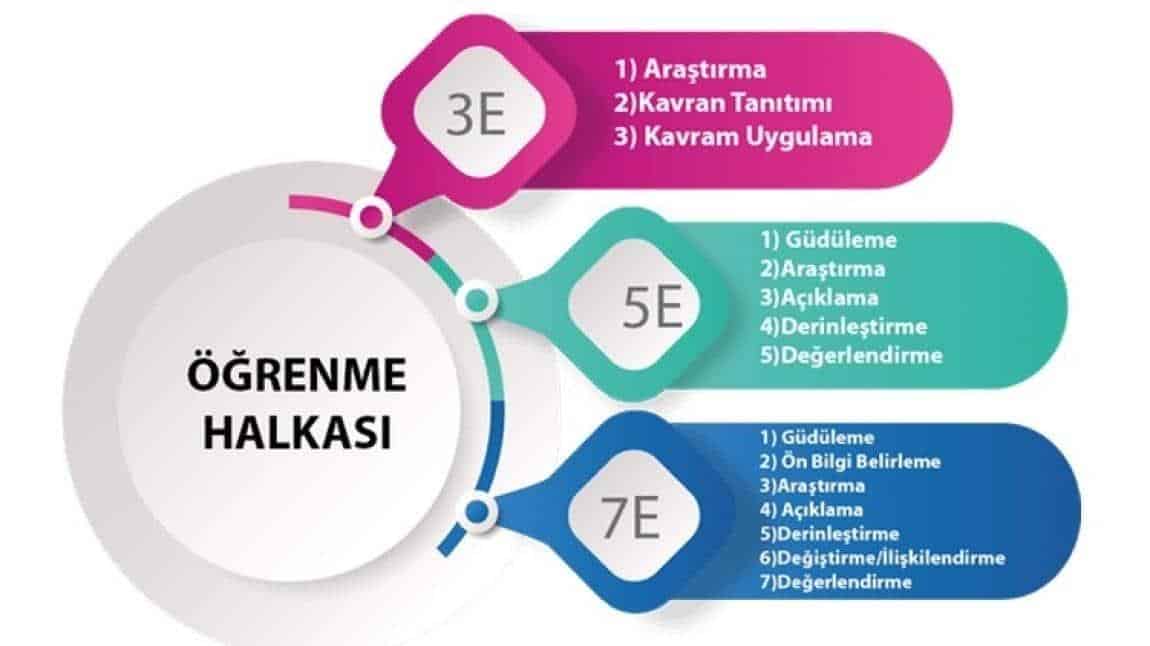
Ortak Okul Projesi Kapsamında asit ve bazlar konusunda 5E modeli uygulanarak, konu detaylı bir şekilde ele alındı.
Ortak okul kapsamında Okulumuzun kimya öğretmeni Semra YILDIRIM ve Nevzat Karabağ Anadolu Lisesi kimya öğretmeni Fatih AKÇALI , 11.sınıf öğrencilerine asit ve bazlar konusunda 5E modeli uygulanarak konu detaylı bir şekilde ele alındı.
|
Ders: |
Kimya |
Sınıf: 11 |
Şube: A-B-C-D |
|
Konu: |
Tarihten Günümüze Asit-Baz |
||
|
Öğrenme Alanı: |
Sınıf Ortamı |
||
|
KAZANIMLAR |
Etkinlikle amaçlanan kazanımlar:
ü Asit ve baz kavramlarının tarihte ilk olarak nasıl kullanıldığını açıklar. ü Arhenius’a göre asit-bazı tanımlar. ü Lowry Bronsted’e göre asit-bazı tanımlar. ü Lewis’e göre asit-bazı tanımlar. ü Farklı asit- baz tanımlarına örnekler verir. ü Bir asit-baz reaksiyonunda konjuge asit-baz çiftlerini belirler. ü Asitlerin metallerle etkileşimi sonucunda hidrojen gazı çıktığını bilir. ü Tarihsel olarak her yeni tanımla asit- baz olarak sınıflandırılan madde sayısının arttığı yargısına varır. ü Teori terimini örnekler vererek açıklar. ü Bilimsel bilginin gelişiminde önceki bilgilerin öneminin farkına varır. ü Bilimsel bilginin değişen anlayışlar sonucunda toplanan yeni kanıtlarla değişebileceğinin farkına varır. ü Bilimin bir insan uğraşı olduğunu fark eder. ü Sınıflandırmada kullanacağı nitel ve nicel ölçütleri belirler. ü Kimyasal maddeler, kavramlar ve olaylar arasındaki karşılıklı ilişkileri, benzerlikleri ve farklılıkları saptar ve sınıflandırır. |
||
|
ARAÇ-GEREÇ: |
Ders Kitabı Etkileşimli tahta, video, resim, eba Ders, V- Snıfı, Kullanılan Öğretim Teknikleri: Gösteri deneyi, Beyin fırtınası, Çalışma yaprağı |
||
|
SÜRE: |
40 Dakika |
||
|
İŞLENİŞ: (5E Modeli) 1- Girme (Engage): (Motivasyon – Dikkat Çekme – Ön bilgileri harekete geçirme) Öğrencilere “çevrelerindeki yiyecek ve içecekleri sınıflandırırken ne tür ölçütler kullanırsınız?” Şeklinde soru sorulur. Öğrencilere 2-3 dakika beyin fırtınası yaptırılır ve seçtikleri ölçütleri belirtmeleri istenir. İfade edilen ölçütler tahtaya yazılır. Böylece öğrenciler kullanacakları ölçütleri belirterek sınıflama süreci üzerine düşünmeye başlarlar. 2- Keşfetme (Explore): |
|||
|
Dersin Adı |
KİMYA |
|
Sınıf |
11 – A-B-C-D |
|
Tarih |
|
|
Bölüm Adı/No |
I.BÖLÜM: KİMYASAL REAKSİYONLARIN HIZLARI |
|
Konu |
Reaksiyon mekanizması, Hız denklemleri ve dereceleri |
|
Önerilen Süre |
2 Ders Saati (40’+40 ‘ ) |
|
Öğrenci Kazanımları / Hedef ve Davranışlar |
HEDEF: mekanizmalı reaksiyonlarda hız denklemlerini yazabilme DAVRANIŞLAR: 1. Reaksiyon mekanizmasını açkılar
4. Reaksiyonun derecesini belirler. |
|
Ünite Kavramları Ve Sembolleri/Davranış Örüntüsü |
Tepkime mekanizması,net tepkime denklemi, hız denklemi hız sabiti,kısmi basınçlar cinsinden hız sabiti ,tepkimenin derecesi,ara ürün, |
|
Güvenlik Önlemleri (varsa) |
-------------- |
|
Öğretme-Öğrenme-Yöntem Ve Teknikleri |
ü Sunuş yoluyla öğrenme, soru cevap, tartışma, problem çözme |
|
Kullanılan Eğitim Teknolojileri- Araç, Gereçler ve Kaynakça |
*Öğretmen:
2. 11.Sınıf kimya Ders Kitapları (Özel yay) 3. Bilgisayar- Projeksiyon *Öğrenci Orta Öğretim Kimya -11 Ders Kitabı (MEB) -Çalışma Kâğıdı (Test -1) |
|
ÖĞRETME-ÖĞRENME ETKİNLİKLERİ: |
|
|
Dikkati Çekme |
ü Üçten fazla, örneğin on taneciğin aynı anda etkin çarpışma yapması ve tek bir çarpışmada ürüne dönüşmeleri mümkün müdür? |
|
ü Güdüleme |
ü Ulaşılmak istenen hedefler açıklanacak |
|
ü Gözden Geçirme |
Çarpışma teorisi ile ilgili eski bilgiler gözden geçirilecek. |
|
ü Derse Geçiş: |
Reaksiyon mekanizması,Hız denklemleri ve dereceleri:
1.DERS:
5 Cl- (suda) + ClO3 - (suda) + 6 H +-------------- > 3 Cl2 (g) + 3 H2O (s)
Reaksiyon mekanizması,Hız denklemleri ve dereceleri: Hız denklemi:
( TH = k’.[PA2]. [ PB2]2 )
Reaksiyon mekanizması,Hız denklemleri ve dereceleri: 2.DERS: Tepkime Derecesi:
Çalışma kâğıtlarındaki (Test-1 deki) sorular ve problemler çözülecek. |
|
ü Bireysel Öğrenme Etkinlikleri (Ödev, deney, problem çözme vb.) |
Ödev: Tepkime hızını etkileyen faktörleri araştırınız. |
|
ü Grupla Öğrenme Etkinlikleri (Proje, gezi, gözlem vb.) |
---------------------------- |
|
ü Özet |
Reaksiyon mekanizması, Hız denklemleri ve dereceleri:
1.DERS:
|
|
|
Reaksiyon mekanizması, Hız denklemleri ve dereceleri: Hız denklemi:
ile ilgili kurallar
Reaksiyon mekanizması, Hız denklemleri ve dereceleri:
2.DERS: Tepkime Derecesi:
|
|
ÖLÇME-DEĞERLENDİRME: |
|
|
Dersin Diğer Derslerle İlişkisi: |
------------------- |
Öğrencilerin verecekleri en muhtemel cevaplardan birisi tat ölçütü olabilir. Bu ölçüte göre maddeleri tatlı, tuzlu, ekşi ve acı olarak sınıflandırabileceklerini ifade ederler. Daha sonra öğrencilere; “seçtiğiniz tat ölçütlerine ne gibi örnekler verebilirsiniz?” “çevrenizde gördüğünüz ve sıkça tükettiğiniz limon, turşu, greyfurt, sirke gibi maddelerin ortak özelliği nelerdir?” şeklinde sorular yöneltilir. Öğrencilerin vereceği muhtemel ortak cevap bu maddelerin tatlarının ekşi olması şeklindedir. Daha sonra öğrencilere “diş macunu, biber gibi maddelerin ortak özellikleri neler olabilir?” denir. Öğrencilerin verebileceği muhtemel ortak cevap bu maddelerin tatlarının acı olduğudur.
3- Açıklama(Explain):
Daha sonra öğretmen tarafından, tıpkı öğrencilerin yaptığı gibi, yüzlerce yıl önce maddeleri ekşi ve acı olarak sınıflandırmanın bilim insanları tarafından da ihtiyaç olarak görüldüğü belirtilir. Önceleri maddelerin kimyasal yapıları bilinmediğinden, tadın bir ölçüt olarak kullanıldığı ve tadı ekşi olan maddeler ekşi anlamına gelen asit, tadı acı olan maddelerin de acı anlamına gelen baz olarak sınıflandırıldığı ifade edilir. Maddelerin asit-baz olarak sınıflandırılmasında tat ölçütüne ek olarak başka hangi ölçütlerin kullanılmış olabileceği sorularak tartışılır ve konu genişletilir.
Öğrencilere rehberlik yapılarak, maddelerin asit olarak sınıflandırılmasında çeşitli maddelerin rengini değiştirebilme, elektriksel iletkenlik, metallere korozif etki yapmaları, oksitler ve karbonatlarla olan reaksiyonları, metallerle etkileşimi sonucunda hidrojen gazının açığa çıkması, bazlarla nötürleşme reaksiyonu vermeleri gibi ölçütlerin kullanılabileceğini belirtirler. Maddelerin baz olarak sınıflandırılmasında da başlangıçta kullanılan tatlarının acı olması ve kayganlık hissi vermeleri ölçütlerine ek olarak günümüzde bazı renkli maddelerin renklerini değiştirme, elektriksel iletkenlik, asitlerle nötralizasyon reaksiyonu vermeleri gibi ölçütlerin dikkate alındığının öğrencilerin farkına varmalarına rehberlik edilir. Duyularla hissedilebilir özellikler üzerine tartışılarak maddeleri asit-baz olarak sınıflandırmada kullanılan ölçütler belirlendikten sonra asit-bazlarla ilgili günümüze kadar çok sayıda tanım yapıldığı, asit ve bazların doğasını açıklamaya yönelik ilk teorinin Arrhenius asit-baz teorisi olduğu ve bunu Lowry-Bronsted, Lewis asit-baz teorilerinin izlediği belirtilir. Daha sonra Arrhenius asit baz teorisi için HCl ve NaOH örnekleri, konjuge asit-baz çiftleri de belirtilerek Lowry-Bronsted asit-baz teorisi için CH3COOH ve HCl nin H2O ile olan reaksiyonu, Lewis asit-baz teorisi için ise BF3’ün NH3 ile olan tepkimesi kullanılarak açıklamalar yapılabilir. Açıklamaların ardından literatürde yer alan ve öğrencilerde sıklıkla rastlanan kavram yanılgılarına vurgu yapılır.
* CO2’nin H içermemesine rağmen asidik özellik gösterdiği, NH3’ün H içermesine rağmen bazik özellik göstermesi örnekleri yanılgıların vurgulanmasında kullanılabilir.
Öğrencilerin; Arrhenius asit-baz teorisi ile açıklanamayan durumların Lowry–Bronsted asit-baz teorisi ile açıklanabildiğini Lowry–Bronsted asit-baz teorisi ile açıklanamayanların da Lewis asit-baz teorisi ile açıklanabildiğini ve eksiklerine rağmen ilk teorilerin de kullanıldığının farkına varmalarını sağlamaya çalışılır.
4- Derinleştirme (Evaluate):
Teorilerin açıklanmasının ardından üç adet deney tüpü alınır ve birinci tüpe NH3, ikinci tüpe HCl, üçüncü tüpe NaOH çözeltilerinden eklenir ve her tüpe içindeki çözeltinin adı yazılır. Öğrencilerden tüplerdeki çözeltilerin asidik mi, bazik mi olduğunu tahmin etmeleri istenir. Daha sonra öğretmen turnusol kâğıdını çözelti örneklerine daldırarak oluşan renk değişimlerini sınıfa gösterir ve öğrencilerden tahminlerinin doğruluğunu test etmelerin istenir. Böylece bilimin doğası kapsamında önemli yeri olan teorilerin işlevinin; olguların ve olgular arası ilişkilerin açıklaması olduğu belirtilir. Asit-baz teorilerinin gelişim süreci dikkate alınarak öğrencilerin; bilimsel gelişmelerle teorilerin yeniden düzenlenebileceğinin veya daha kapsamlı yeni teorilerin geliştirilebileceğinin farkına varmaları sağlanır. Daha sonra; asit-baz teorilerinde görüldüğü gibi bilimsel bilgilerin değişen anlayışlar ve teknolojik gelişmelerle değişebileceği, gelişebileceği, bilimin bir insan uğraşı olduğu yönünde açıklamalar yapabilir.
5- Değerlendirme
Bütün tartışma ve açıklamalardan sonra öğrencilere çalışma yaprağı dağıtılır ve soruları cevaplamalarını istenir. 5 dakikalık sürenin ardından çalışma yaprakları toplanır, doğru cevaplar verilerek öğrencilerin cevapları ile ilgili geri bildirim verilir ve tartışılır. Ayrıca Dersin sonunda
Ölçme Değerlendirme Genel Müdürlüğü’nün hazırlamış olduğu kazanım testileri ödev olarak
verilir.
*Yaygın olarak rastlanan kavram yanılgıları:
- H içeren bütün bileşikler asittir.
- Bir maddenin asidik özellik gösterebilmesi için yapısında H bulundurmalıdır.
- OH içeren bütün bileşikler bazik özellik gösterir.
Çalışma Yaprağı
DERS PLANI
BÖLÜM -1
BÖLÜM -2
BÖLÜM III ÖLÇME-DEĞERLENDİRME:
BÖLÜM -4
28/ 03/2024
Fatih AKÇALI
Kimya / Kimya Teknolojisi Öğretmeni

